| تغییرات آنتالپی مربوط به تراکم یونهای گازی شکل مثبت و منفی به یک بلور را انرژی شبکه آن بلور مینامند. برای مثال انرژی شبکه کلرید سدیم 788- کیلو ژول بر مول است. |
  |
علامت انرژی شبکه
از آنجا که در اینگونه فرآیندها همواره انرژی آزاد میشود، تمام انرژیهای شبکه علامت منفی دارند. برعکس انرژی مورد نیاز برای جدا کردن یونهای یک مول بلور برابر انرژی شبکه با علامت مثبت است. 
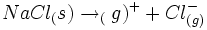
اهمیت انرژی شبکه را با استفاده از روش تحلیلی که توسط ماکس بور و فرتینر هابر در سال 1917 جدا از یکدیگر تکوین یافت، میتوان مشاهده کرد. چرخه "بور - هابر" برای تولید کلرید سدیم از عناصر مربوط مورد استفاده قرار میگیرد. تحلیل "بور - هابر" بر اساس قانون هس قرار دارد. قانون هس میگوید که تغییر آنتالپی هر نوع واکنش شیمیایی مقداری است ثابت ، خواه واکنش در یک مرحله و خواه در چند مرحله صورت گیرد.
تغییر آنتالپی تولید یک مول 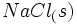 در یک مرحله از
در یک مرحله از 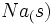 و
و 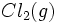 ، آنتالپی تشکیل این ترکیب است.
، آنتالپی تشکیل این ترکیب است.

میتوانیم تولید یک مول  را از
را از 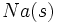 و
و  در چند مرحله تصور کنیم. جمع جبری مقادیر ΔH در این مراحل باید بر اساس قانون هس برابر آنتالپی تشکیل
در چند مرحله تصور کنیم. جمع جبری مقادیر ΔH در این مراحل باید بر اساس قانون هس برابر آنتالپی تشکیل  که مراحل ΔH واکنش در یک مرحله است، باشد. مراحل مزبور به قرار زیر است.
که مراحل ΔH واکنش در یک مرحله است، باشد. مراحل مزبور به قرار زیر است.
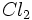 گازی تفکیک میشود و به یک مول اتم Cl گازی تبدیل میگردد. آنتالپی تفکیک
گازی تفکیک میشود و به یک مول اتم Cl گازی تبدیل میگردد. آنتالپی تفکیک  که انرژی پیوندی Cl - Cl نیز نامیده میشود، برابر 243Kj برای هر مول
که انرژی پیوندی Cl - Cl نیز نامیده میشود، برابر 243Kj برای هر مول 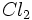 است. از آنجا که تنها نیم مول
است. از آنجا که تنها نیم مول 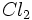 در این عمل مورد نیاز است، انرژی تفکیک نیر نصف میشود. ( 122+ Kj )
در این عمل مورد نیاز است، انرژی تفکیک نیر نصف میشود. ( 122+ Kj ) ، برابر اولین الکترون خواهی کلر است. در این فرایند انرژی آزاد میشود، (349 - کیلو ژول) این اولین مرحلهای است که در آن انرژی آزاد میشود. اما انرژی آزاد شده ، انرژیهای مورد نیاز مراحل پیشین را تامین نمیکند.
، برابر اولین الکترون خواهی کلر است. در این فرایند انرژی آزاد میشود، (349 - کیلو ژول) این اولین مرحلهای است که در آن انرژی آزاد میشود. اما انرژی آزاد شده ، انرژیهای مورد نیاز مراحل پیشین را تامین نمیکند. برابر 788- کیلو ژول است که نشانه آزاد شدن انرژی است. روشن است که بیشتر انرژی آزاد شده در کل واکنش ، از این مرحله ناشی میشود. یعنی این مرحله است که زمینه انجام این فرآیند را از نظر انرژی مساعد میکند.
برابر 788- کیلو ژول است که نشانه آزاد شدن انرژی است. روشن است که بیشتر انرژی آزاد شده در کل واکنش ، از این مرحله ناشی میشود. یعنی این مرحله است که زمینه انجام این فرآیند را از نظر انرژی مساعد میکند. خواهد بود، که به صورت زیر است:
خواهد بود، که به صورت زیر است:
مورد استفاده چرخه "بور - هابر"
از چرخههای "بور - هابر" ، برای تحلیل فرآیندها و پی بردن به اینکه تغییر در یک مرحله چه اثری در کل فرآیند خواهد داشت، استفاده میکنند. این چرخهها را میتوان برای محاسبه تغییر آنتالپی یکی از مراحل یا کل فرآیند نیز بکار برد.
بطورکلی مقدار انرژی شبکه به دو عامل بستگی دارد:
هنگام تشکیل بلور هر چه بار یونهای بوجود آورنده بلور بیشتر باشد، انرژی شبکه زیادتری آزاد میشود. زیرا هر چه قدر مطلق بارهای مثبت و منفی بزرگتر از هم باشد، به همان نسبت جاذبه بین آنها قویتر و انرژی آزاد شده بیشتر است.
هر چه فاصله دو بار ناهمنام کمتر باشد، نیروی جاذبه قویتر و انرژی آزاد شده بیشتر خواهد بود. لذا انرژی شبکه بلور ناشی از یونهای کوچکتر که توانایی نزدیکتر شدن دارند، بیش از انرژی شبکه بلور ناشی از یونهای بزرگتر است، به شرط اینکه بار یونهای ترکیب یکسان باشد. از آنجا که یون  کوچکتر از یون
کوچکتر از یون 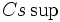 است، اختلاف انرژی شبکه (NaCl (-788Kj/mol و (CsCl (- 669Kj/mol شگفت آور نیست.
است، اختلاف انرژی شبکه (NaCl (-788Kj/mol و (CsCl (- 669Kj/mol شگفت آور نیست.
کلمات کلیدی: ترمو دینامیک